政策红利释放,医用蚕丝产品更需一张“身份证”
上传更新:2025-09-10
十项支持举措,高端医疗器械产业迎创新拐点
严格把控,医疗器械注册成创新“守门人”
注册证=市场身份证+技术通行证?
双三类证加身,星月生物在新型生物材料领域实现两大突破
下一篇:抱歉暂无数据

01
十项支持举措,高端医疗器械产业迎创新拐点
随着现代医疗水平的不断发展,医疗器械已广泛用于疾病的诊断、预判、监护、治疗或缓解等。今年7月,国家药监局发布《国家药监局关于发布优化全生命周期监管支持高端医疗器械创新发展有关举措的公告(2025年第63号)》,这一利好政策的出台无疑为高端医疗器械行业发展注入了强劲动力。
公告明确指出全力支持高端医疗器械重大创新,促进更多新技术、新材料、新工艺和新方法应用于医疗健康领域,尤其是医用机器人、高端医学影像设备、人工智能医疗器械和新型生物材料医疗器械等塑造医疗器械新质生产力的关键领域,并提出优化特殊审批程序等十项支持举措,为行业创新发展提供明确的政策指引。
02
严格把控,医疗器械注册成创新“守门人”
医疗器械技术与产业发展关乎国民健康保障,高端医疗器械的自主创新及国产化是我国医疗体系健康发展的技术支撑与重要保障。然而,当前临床大部分高端医疗器械仍依赖进口,这一现状亟待突破。
近年来,我国医疗器械市场规模呈持续增长态势,增长动力主要来源于三方面,一是人口老龄化进程加快、慢性病患病率攀升;二是群众健康意识增强,医疗需求持续释放;三是国家政策持续加码,支持高端医疗器械的创新突破。
同时,医疗器械作用于人体,其安全性和有效性直接涉及人体健康与生命安全,必须严格把控。因此,医疗器械注册成为产品上市的关键环节,其科学性和规范性显得尤为重要。
03
注册证=市场身份证+技术通行证?
医疗器械注册是指食品药品监督管理部门根据医疗器械注册申请人的申请,依照法定程序,对其拟上市医疗器械的安全性、有效性研究及其结果进行系统评价,以决定是否同意其申请的过程。医疗器械注册分为境内与境外,根据其使用安全性及风险等级分为三类:
第一类 风险程度低,实行常规管理可以保证其安全、有效的医疗器械。
第二类 是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。
第三类 是具有较高风险,需要严格控制管理以保证其安全、有效的医疗器械。
对企业而言,医疗器械注册证具有双重意义:一方面,它是企业产品合法进入市场的“身份证”,只有获得注册证,企业才能将产品推向市场进行销售;另一方面,注册证更是产品安全有效性的权威认证,尤其在高端医疗器械领域,获得注册证代表着企业的技术实力已通过国家监管部门的严格验证。这一认证不仅关乎市场准入,更是企业核心竞争力的重要体现。
04
双三类证加身,星月生物在新型生物材料领域实现两大突破
在新型生物材料医疗器械领域,星月生物团队早在2005年便率先开拓医用蚕丝赛道。作为生物材料中的天然高分子材料,丝素蛋白对人体无害,安全可靠,具有良好的生物相容性,适用于开发功能性材料,通过研发技术可制备成纤维、薄膜、海绵、粉末等不同性状的材料。
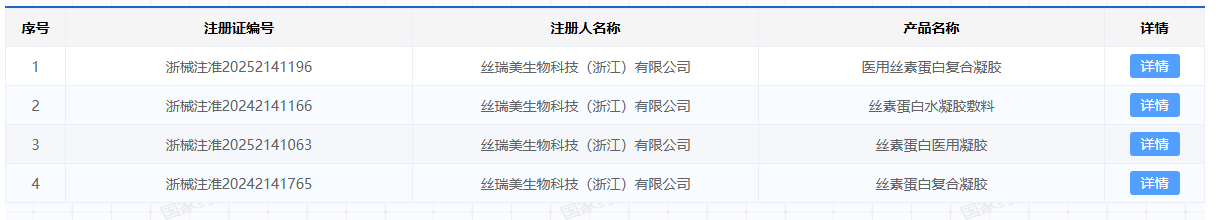
目前,星月生物历经近20年的技术沉淀,已将丝素蛋白成功应用到医疗器械、医疗美容、功效护肤等领域。在医疗器械领域,星月生物及其子公司丝瑞美生物已累计获得10项医疗器械注册证,其中,2项是三类医疗器械注册证。
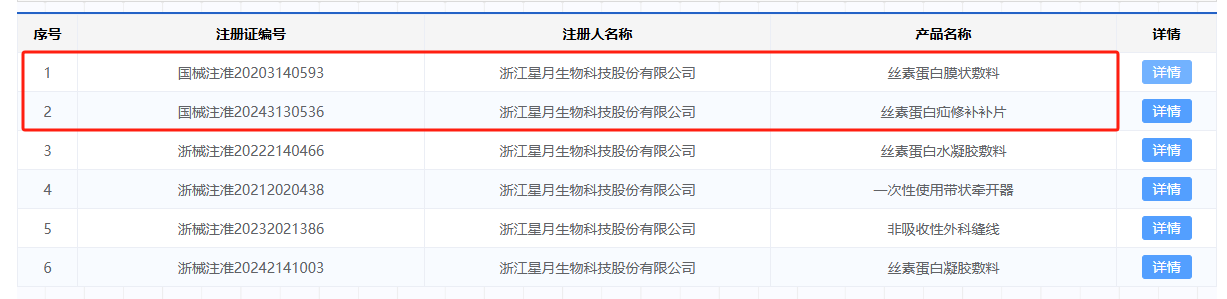
丝素蛋白膜状敷料于2020年获三类医疗器械注册证,是透明状的再生丝素蛋白膜。该产品由5A级及以上的桑蚕丝制备而得的透明、致密、光滑、透气的薄膜,适用供皮区覆盖。
多中心临床验证的蚕丝材料疝修补产品——丝素蛋白疝修补补片,于2024年获三类医疗器械注册证,并被纳入《浙江省重点新材料首批次应用示范指导目录(2024年版)》。该产品由桑蚕丝经经编、脱胶处理等工艺制成的网状补片,其成分为丝素蛋白,适用于开放性腹腔外修补腹股沟疝。

随着国家药监局优化全生命周期监管政策的落地,高端医疗器械产业正迎来前所未有的发展机遇。星月生物凭借在新型生物材料领域的前瞻性布局和近20年的技术积累,将进一步推动从基础研究到产业化应用的跨越。
